研究概要

分析化学とは、様々な対象を「はかる」ための理論や実験手法を創る学問です。当研究室ではマイクロ・ナノテクノロジーを駆使した分析化学の研究に取り組んでいます。基盤技術の一つはマイクロ流体デバイスです。これはプレパラート大の板に、髪の毛ほどの太さの流路を作製してその中で分析操作をおこなう、いわば手のひらサイズの実験室です。このマイクロ流路はビーカーやフラスコといった実験器具に比べて格段に小さいので、極めて少ない量の試料と試薬で、短時間に分析できます。当研究室ではこのデバイスを用いた生体材料の分析法の開発に力を注いでいます。医療診断や環境・バイオ分析など幅広い応用を目指すと共に、生命現象に対する理解を深め、「生命のしくみを化学の言葉で解き明かす」のが究極の目標です。
生体膜分子分析デバイス
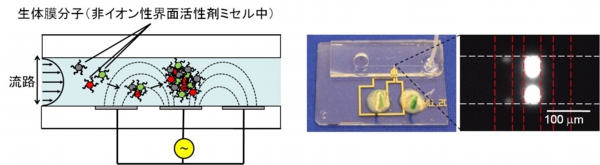
マイクロ流路の内部に電極を配置して用いる事で、電極反応を利用して目的の分子を検出したり、電場を利用して物体や溶液を電気的な力で動かす事が出来ます。中でも、μmスケールの空間で電極に交流電圧を加えると、私たちの身の回りでは見られない溶液の流れや物体の動きが観察されます。
当研究室では、これらの現象について理論と実験の両面から検討を進めると共に、様々なバイオ分析への応用を図っています。例えば、マイクロ流路内の交流電場を用いると、細胞膜上に微少量存在する膜タンパク質を濃縮して高感度に分析できます。世の中の薬物の半数は、膜タンパク質に作用することで効果を発揮しますので、薬物の作用に伴う膜タンパク質の変化を高感度に検出する事で、創薬分野に大きな貢献ができるでしょう。
文献
- Yuya USUI, Naoki SASAKI, "Alternating Current Cloud Point Extraction on a Microfluidic Chip: the Use of Ferrocenyl Surfactants" Analytical Sciences, 32(1), 109-111 (2016).
- 佐々木直樹, 交流動電現象のマイクロチップバイオ分析への応用, 分析化学、64、1-8 (2015).
- Naoki SASAKI, Chisaki MAEKAWA, Kae SATO, "Alternating current cloud point extraction on a microchip: the effect of electrode geometry" Electrophoresis, 36(3), 424-427 (2015).
- Naoki SASAKI, “Recent applications of AC electrokinetics in biomolecular analysis on microfluidic devices” Analytical Sciences, 28(1), 3-8 (2012).
- Naoki SASAKI, Azusa TAKEMURA, Kae SATO, “Alternating current cloud point extraction on a microchip: a comprehensive study” Electrophoresis, 33(21), 3159-3165 (2012).
- Naoki SASAKI, Kazuo HOSOKAWA, Mizuo MAEDA, “Alternating current cloud point extraction on a microchip for preconcentration of membrane-associated biomolecules” Lab on a Chip, 9(9), 1168-1170 (2009).
1分子DNA分析
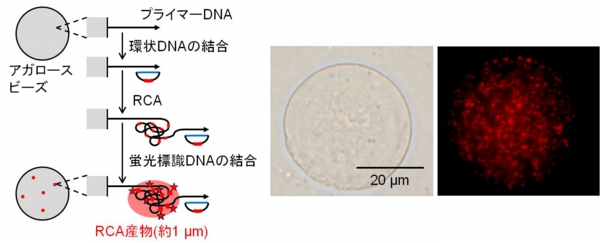
DNAは4種類の核酸塩基が連なった「生命の設計図」であり、塩基配列の異常は様々な病気と関連しています。また、塩基配列を調べることで、そのDNAが何の生物に由来するかを知ることもできます。塩基配列を肉眼で読む事はできません。しかし、標的配列とハイブリダイズして環状になるDNAと酵素を用いると、目的の塩基配列が存在する時にのみ、非常に長いDNAが合成されます(Rolling Circle Amplification: RCA)。塩基配列が一つでも違うと、この合成は起こりません。また、合成されたDNAは1個でも顕微鏡で検出でき、単一DNA中の一塩基の違いを目で見て調べる事ができます。
当研究室では、このRCA法に基づくDNA増幅・単分子検出に取り組んでいます。上の図に示すように、マイクロビーズ上でRCA法を行うことで、一つ一つの増幅産物を蛍光輝点として観察できます。現在、この手法をマイクロ流体デバイスと組み合わせ、迅速・超高感度なDNA分析法としての応用を図っています。
文献
- Naoki SASAKI, Yoshitaka GUNJI, Chikako KASE, Kae SATO, "Molecular crowding improves bead-based padlock rolling circle amplification"Analytical Biochemistry, 519, 15-18 (2017).
- Kae SATO, Reina ISHII, Naoki SASAKI, Kiichi SATO, Mats NILSSON, "Bead-based padlock rolling circle amplification for single DNA molecule counting" Analytical Biochemistry, 437(1), 43-45 (2013).
- Naoki SASAKI, Anri ISU, Reina ISHII, Kae SATO, “Photochemical immobilization of cells onto a glass substrate for in situ DNA analysis” Analytical Sciences, 28(6), 537-539 (2012).
無細胞マイクロ生体モデル
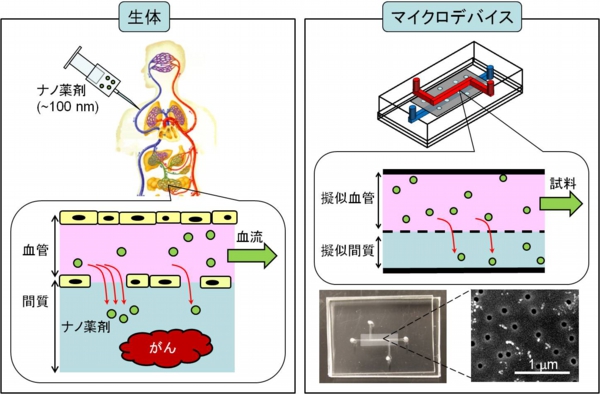
薬物の効果を調べるために、様々な評価系が用いられています。しかし、培養細胞を用いる系は生体に比べてサイズや環境が大きく異なりますし、実験動物はコストが高く倫理面の問題もあります。そこで本研究室では、マイクロ流体デバイスを利用した新たな生体モデルの開発に取り組んでいます。
ここでは、ナノ薬剤を評価するための無細胞マイクロ生体モデルをご紹介します。ナノ薬剤を生体に投与すると、目的部位に選択的に送り届けられるため、効果的な治療が可能です。しかし、生体は極めて複雑であるため、ナノ薬剤が「効く・効かない」は評価できても、「なぜ効く・効かない」を明らかにできません。そこで、血管と同程度のサイズのマイクロ流路を擬似血管とみなして用いることで、血管からナノ薬剤が漏れ出て腫瘍へと到達する過程を模擬できます。生体内に近い状態でナノ薬剤の性能を精密に評価し、ナノ薬剤による疾病治療のメカニズムを明らかにする実験モデルを目指して、医学・薬学系研究者と連携して研究を進めています。
文献
- Yumi MORIYA, Miki ODANAKA, Naoki SASAKI, “Simulation of nanoparticle extravasation using an easy-to-observe membrane-intgrated microfluidic device”, Proc. Micro Total Analysis Systems 2017, 1211-1212 (2017).
- Naoki SASAKI, Mariko TATANOU, Tomoko SUZUKI, Yasutaka ANRAKU, Akihiro KISHIMURA, Kazunori KATAOKA, Kae SATO, "A Membrane-Integrated Microfluidic Device to Study Permeation of Nanoparticles through Straight Micropores toward Rational Design of Nanomedicines" Analytical Sciences, 32(12), 1307-1314 (2016).
- 佐々木直樹、佐藤香枝、マイクロ血管モデルの構築と分析化学的応用、分析化学、65、241-247 (2016).
- Miwa SATO, Naoki SASAKI, Manabu ATO, Satoshi HIRAKAWA, Kiichi SATO, Kae SATO, "Microcirculation-on-a-chip: a microfluidic platform for assaying blood- and lymphatic-vessel permeability", PLOS ONE, 10(9), e0137301 (2015).
- Naoki SASAKI, Jun-ichiro JO, Ichio AOKI, Kae SATO, "Magnetic resonance imaging of a microvascular-interstitium model on a microfluidic device" Analytical Biochemistry, 458, 72-74 (2014).
- Kae SATO, Naoki SASAKI, Helene Andersson SVAHN, Kiichi SATO, “Microfluidics for nano-pathophysiology” Advanced Drug Delivery Reviews, 74, 115-121 (2014).
- Naoki SASAKI, Mika SHINJO, Satoshi HIRAKAWA, Masahiro NISHINAKA, Yo TANAKA, Kazuma MAWATARI, Takehiko KITAMORI, Kae SATO, “A palmtop-sized microfluidic cell culture system driven by a miniaturized infusion pump” Electrophoresis, 33(12), 1729-1735 (2012).


