研究内容
細胞工学的アプローチを用いた新規運動制御性マイオカインの研究
背景
運動は、骨格筋での代謝を直接亢進させるとともに筋発達を促進して体全体での基礎代謝量を上昇させる。また、骨格筋細胞以外に対しても、例えば、骨格筋周辺の毛細血管量の増大、脂肪細胞における脂肪分解の促進、脳神経系における神経新生の促進、免疫能の亢進など、様々な影響を与える。しかし、このような運動依存的な生理的変化を惹起する分子メカニズムについては未だ不明な点が多い。その主な理由のひとつは、運動の研究に適した優れた培養筋細胞系が存在しなかったため、研究手法が限定的であったことにある。
運動研究が可能な細胞モデルの開発
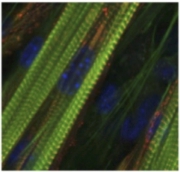 Fig.1 高度発達型C2C12筋細胞我々は、培養筋管細胞C2C12の培養条件などを細かく検討することで、細胞深部にまで筋収縮に必須なサルコメラユニットを保持した高度発達型培養筋細胞系の構築に成功した (Fig. 1)。さらに、この細胞に電気パルス刺激を加えることによって人為的に収縮刺激のオン・オフをコントロールできる全く新しいin vitro擬似的運動刺激系を世界で初めて開発し、この擬似的運動刺激系が骨格筋において運動がどのような細胞応答を引き起こすのかを解析する上で極めて強力な系であることを明らかにした (1,2)。
Fig.1 高度発達型C2C12筋細胞我々は、培養筋管細胞C2C12の培養条件などを細かく検討することで、細胞深部にまで筋収縮に必須なサルコメラユニットを保持した高度発達型培養筋細胞系の構築に成功した (Fig. 1)。さらに、この細胞に電気パルス刺激を加えることによって人為的に収縮刺激のオン・オフをコントロールできる全く新しいin vitro擬似的運動刺激系を世界で初めて開発し、この擬似的運動刺激系が骨格筋において運動がどのような細胞応答を引き起こすのかを解析する上で極めて強力な系であることを明らかにした (1,2)。
「マイオカイン仮説」の証明と新規運動制御性マイオカインの発見
我々は、本系を使って運動依存的な遺伝子発現変化を網羅的に調べたところ、CXCケモカインファミリー (CXCL1/KC, CXCL5/LIX)など多数の分泌タンパク質をコードする遺伝子の発現が運動依存的に上昇することを初めて見出し、これらのタンパク質は実際に骨格筋細胞の収縮によって分泌上昇することも証明した (1,3)。
2000年、Pedersenらは、in vivoモデルを用い、骨格筋において運動依存的なIL-6 mRNA量が増加することを発見 (4)、2005年に“骨格筋は内分泌器官であり、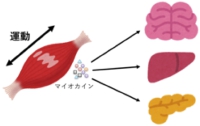 Fig.2 マイオカインネットワーク その分泌タンパク質量は運動によって制御されるのではないか”という「マイオカイン仮説」を提唱した (5)。我々の成果は、筋収縮によって骨格筋からのマイオカイン分泌が変化することをはじめて直接的に可視化し、この「マイオカイン仮説」の最終的な証明に貢献するものであった (Fig.2)。
Fig.2 マイオカインネットワーク その分泌タンパク質量は運動によって制御されるのではないか”という「マイオカイン仮説」を提唱した (5)。我々の成果は、筋収縮によって骨格筋からのマイオカイン分泌が変化することをはじめて直接的に可視化し、この「マイオカイン仮説」の最終的な証明に貢献するものであった (Fig.2)。
現在、本擬似的運動刺激系およびこれを改良した系は、世界中の多くの研究室でマイオカイン研究の重要なツールとなっており、その後も多くの新しい運動制御性マイオカインが報告され続けている。
新規運動抑制性マイオカインの発見
最近、我々は、擬似的運動刺激系と分泌タンパク質アレイ法を組み合わせることによって、新しいマイオカインの同定に成功した (6)。これまでに報告されてきた運動制御性マイオカインは、そのほとんど全てが運動によって分泌が上昇するものであった。しかし、我々が同定した新規マイオカインCXCL10は、筋収縮によって分泌が「減少」する珍しいものであった。運動によって発現低下する唯一のマイオカインとしてmyostatinが提唱されてきたが、我々が同定したCXCL10はこれに続く世界で2例目の「運動抑制性マイオカイン」である。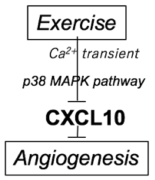 Fig. 3 運動抑制性マイオカインCXCL10
Fig. 3 運動抑制性マイオカインCXCL10
さらにこのCXCL10は強力な血管新生抑制因子としての作用があるため、運動によるCXCL10分泌量の減少は、血管機能に良好な効果を持つ可能性がある。加齢や糖尿病発症にともなって血管機能が低下、運動はこの血管機能低下を予防することが知られているが 、その仕組みについては不明な点が多かった。今回我々が発見した運動による新規マイオカインCXCL10の分泌減少は、これを説明する有力な候補であると考えられる。さらに我々は3例目の運動抑制性マイオカインとしてCCL5を新規同定、その生理的意義を解析している。
現在も、我々は擬似的運動刺激系と先進的な細胞生物学的手法および各種動物実験を組み合わせ、新しいマイオカインの探索、その発現制御機構と生理的意義の解明を目指した研究を推進している。
参考文献
(1) Nedachi et al., Am J Physiol Endocrinol Metab. 2008 295(5):E1191-204.
(2) Fujita et al., Exp Cell Res. 2007 313(9):1853-65
(3) Nedachi et al., Am J Physiol Endocrinol Metab. 2009 297(4):E866-78.
(4) Jonsdottir IH et al., J Physiol. 2000 528 Pt 1:157-63.
(5) Febbraio MA and Pedersen BK. Exerc Sport Sci Rev. 2005 33(3):114-9.
(6) Ishiuchi et al., Biosci Biotech Biochem, 2018 82(1): 97-105.
(7) Ishiuchi et al., Cytokine. 2018 108:17-23.
細胞間コミュニケーションによる多細胞生物のホメオスタシス維持
背景
多細胞生物は、複数のタイプの細胞間コミュニケーションを有効に活用することで体全体のホメオスタシスを維持している。我々は複数の細胞工学的手法を組み合わせながら、新しい細胞間コミュニケーションの発見と理解、さらには応用についての研究を行なっている。
Ht22細胞の異なる強度のストレスに対する細胞応答
 Fig.4 マウスHt22細胞マウス海馬由来Ht22細胞はグルタミン酸受容体を保持しておらず、高濃度グルタミン酸添加による酸化ストレス研究に汎用されている細胞である (Fig. 4)。我々は、種々の濃度のグルタミン酸あるいはH2O2でHt22細胞を処理し、細胞生存に与える影響を精査した。その結果、高濃度のグルタミン酸あるいはH2O2処理 (強酸化ストレス負荷)では既報通り細胞死が誘導されたが、興味深いことに極低濃度のグルタミン酸あるいはH2O2処理 (弱酸化ストレス負荷)では逆に細胞死が抑制されることを見出した (10)。
Fig.4 マウスHt22細胞マウス海馬由来Ht22細胞はグルタミン酸受容体を保持しておらず、高濃度グルタミン酸添加による酸化ストレス研究に汎用されている細胞である (Fig. 4)。我々は、種々の濃度のグルタミン酸あるいはH2O2でHt22細胞を処理し、細胞生存に与える影響を精査した。その結果、高濃度のグルタミン酸あるいはH2O2処理 (強酸化ストレス負荷)では既報通り細胞死が誘導されたが、興味深いことに極低濃度のグルタミン酸あるいはH2O2処理 (弱酸化ストレス負荷)では逆に細胞死が抑制されることを見出した (10)。
この相反する生理作用を仲介する分子メカニズムの解明をめざして、まず、ストレスに応答して活性化されることが報告されているMAP kinase (Erk1/2, JNK, p38など)に着目した研究を行った。その結果、強酸化ストレス負荷は、細胞生存を負に調節するp38と正に調節するErk1/2両者の活性化を引き起こしたが、弱酸化ストレス負荷ではErk1/2の活性化のみが見出された。この弱酸化ストレス依存的なErk1/2活性化は細胞保護効果に重要な変化である (11)。
一方、先に述べたように強酸化ストレス負荷は細胞死を誘導するが、この時に細胞保護機構が稼働しているかどうかを調べた。その結果、大変興味深いことに、強酸化ストレス負荷によって特定の増殖因子の遺伝子発現が有意に増加していることが見出された。我々はHt22細胞においてこの増殖因子が神経保護効果を示すことを見出しており、この結果をあわせると、神経細胞が細胞死に向かう過程で増殖因子発現を増強し、オートクライン/パラクライン的に細胞保護機構を稼働していることがはじめて示された。
参考文献
(10) Sato K et al., Biosci Biotechnol Biochem. 2014 78(9):1495-503.
(11) Sato K et al., Biosci Biotechnol Biochem. 2016 80(4):712-8.
脳内のストレスと成長因子プログラニュリン
認知症のひとつである前頭側頭葉変性症 (frontotemporal labor degeneration; FTLD)は、脳全体が委縮するアルツハイマー症(AD)とは異なり、大脳の前頭葉と側頭葉に限局した委縮が見られる型の認知症である.症状もADとは対照的に記憶障害は軽度である一方、意欲低下や攻撃性向の増大などの人格変化を示すことが知られている。若年発症型認知症に占めるFTLD患者の割合は約1割と比較的高く、またADを含む他の認知症と比較して発症年齢が低いことなどから、FTLD発症過程の解明ならびに適切な早期診断法、治療法の開発は極めて重要である。最近になって、FTLDの一部とプログラニュリン遺伝子の変異が極めてよく連関していることが報告された。このことは、PGRN遺伝子の変異により神経細胞が変性するというメカニズムの存在を示唆していた (12)。
 Fig.5 マウス神経前駆細胞我々は最近、PGRNがマウス胎仔海馬由来神経前駆細胞 (Fig. 5)の増殖を促進する活性を保持していること、成熟ニューロンの細胞死を抑制する活性を保持していることを明らかにした。さらに、これまで全く不明であった脳神経系細胞内でプログラニュリンによって制御される細胞内シグナルとしてGSK3βを世界に先駆けて発見することにも成功した。また、ごく最近、マウス個体を用いた脳虚血後再かん流実験を行い、大脳皮質と海馬領域におけるプログラニュリン遺伝子発現量が有意に上昇することを確認している。
Fig.5 マウス神経前駆細胞我々は最近、PGRNがマウス胎仔海馬由来神経前駆細胞 (Fig. 5)の増殖を促進する活性を保持していること、成熟ニューロンの細胞死を抑制する活性を保持していることを明らかにした。さらに、これまで全く不明であった脳神経系細胞内でプログラニュリンによって制御される細胞内シグナルとしてGSK3βを世界に先駆けて発見することにも成功した。また、ごく最近、マウス個体を用いた脳虚血後再かん流実験を行い、大脳皮質と海馬領域におけるプログラニュリン遺伝子発現量が有意に上昇することを確認している。
これら一連の結果は、脳神経系細胞がストレスを受けるとプログラニュリンが産生増加することにより神経前駆細胞が増加するとともに成熟ニューロン死が抑制され、総合的に脳神経系を保護するメカニズムが存在することを示唆している。一方、プログラニュリンに変異が生じると、この神経保護メカニズムがうまく機能しなくなり、FTLDをはじめとする神経変性疾患を発症する可能性がある。また脳神経系細胞内でのプログラニュリン発現は、エストロゲンなどの性ステロイドやストレス負荷によって増加するため、このメカニズムを解明することで認知症予防や治療法開発へとつながることも期待される (13)。
一方、脳内でのPGRNの生理作用発現機構の全容は未だ不明な点が多く、現在、PGRN低下にともない神経前駆細胞内で発現変動する遺伝子の網羅的同定を進めている。さらに、脳内でのPGRN発現制御についても明らかになっていない点が多いため、各種神経細胞を用いたPGRN発現制御メカニズムについても解析を進めている (14)。
参考文献
(12) Suzuki et al., 2009 J Reprod Dev. 55(4):351-5.
(13) Nedachi et al., Neuroscience. 2011 185:106-15.
(14) Kawashima et al., FEBS Open Bio. 2016 7(2):149-159.
