放射線抵抗性細菌のDNA修復機構の解明研究
デイノコッカス・ラジオデュランス(Deinococcus radiodurans)は、非病原性、無芽胞性の真正細菌で、放射線抵抗性細菌として知られています。ラジオデュランスは、1956年に米国・オレゴン州の缶詰工場で発見されました。牛肉を詰めた缶詰に放射線を照射した後でも増殖していたのです。ラジオデュランスは、放射線照射で起こるDNA2本鎖切断を修復する能力に長けているのが特徴です。2本鎖切断はわずかな量でもほとんどの生物にとって致死的ですが、ラジオデュランスは、ゲノムに生じた100箇所以上の2本鎖切断を照射後培養している間に完全に元通りに修復してしまいます。放射線微生物学研究室では、ラジオデュランスが持つ著しく効率の良いDNA2本鎖切断修復の分子機構の全容を解明するための研究を進めています。
DNA修復遺伝子群の同定
今から約20年前、当時の日本原子力研究所高崎研究所で、ラジオデュランスのもつ効率良くしかも正確なDNA二本鎖切断修復の分子メカニズムを解明する研究がスタートしました。我々がとった研究戦略は、ラジオデュランスから分離された放射線感受性変異株(遺伝子のどこかに変異が起こったため放射線に弱くなった菌)の原因遺伝子を同定することでした。具体的には、正常株から抽出したさまざまなDNA領域の断片を変異株に与えて、変異株を放射線耐性に復帰させることのできるDNA領域を限定する作業を繰り返し、限定した正常株由来のDNA領域の塩基配列を変異株のものと比較することで、遺伝子の変異部位を同定したのです。初期の実験で同定した遺伝子は、RecA、RecN、RecRといった相同組換え修復に関与するタンパク質の遺伝子でした。しかしながら、大腸菌などの放射線に弱い一般的な細菌でもこのようなDNA修復遺伝子をもっているので、これらの遺伝子の機能だけでラジオデュランスの放射線耐性を説明することは難しいと思われました。
新規DNA修復遺伝子の発見
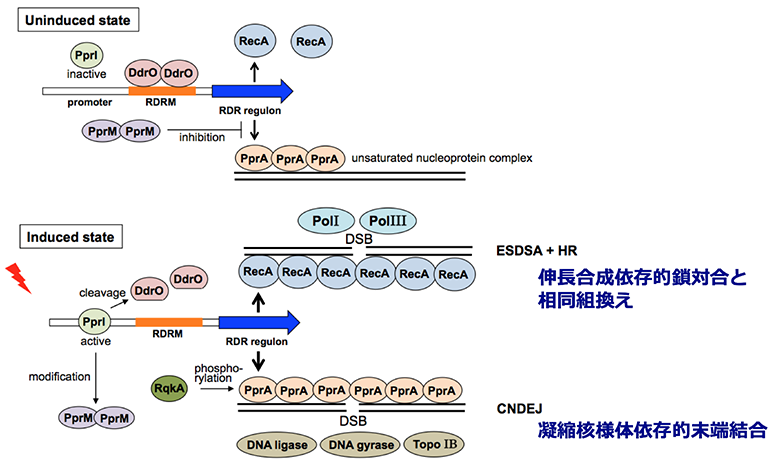
我々は、ラジオデュランスの放射線感受性変異株の原因遺伝子の同定実験を続行し、ラジオデュランスの放射線耐性に重要な新規遺伝子を同定することに成功しました。同定した遺伝子は、機能未知遺伝子に分類されていたもののひとつでした。この遺伝子のDNA塩基配列を調べたところ、変異株では正常株と較べてたった1箇所が異なっていることが分かりました。すなわち、変異株ではひとつの遺伝子のたった1箇所の変異によって、放射線耐性が失われていたのでした。この遺伝子から作られるタンパク質の性質を解明するまでには、かなり多くの時間がかかりました。なぜなら、このタンパク質のアミノ酸配列は既知のどのタンパク質にも似ておらず、また、ヒントとなるアミノ酸配列上のモチーフもまったくなかったからです。このタンパク質とDNAを試験管内で混合し、いろいろと解析した結果、DNA鎖が切れた部分を認識して結合することにより、DNA分解酵素からDNA鎖の末端を保護するとともに、DNAリガーゼによるDNA鎖切断の修復を高効率で促進する作用をもつことが分かりました。また、このタンパク質は、放射線で生じるDNA損傷だけではなく、紫外線やDNA架橋剤で生じる性質の異なる損傷の修復も同様に促進しました。そこで、この新規タンパク質を「DNA修復を促進する多面的タンパク質」の英語表記(pleiotropic protein promoting DNA repair)の頭文字を取って,PprAと命名しました。また、PprAタンパク質は放射線を照射した後にラジオデュランスの細胞の中で発現が急激に大量誘導される、いわゆる放射線誘導性タンパク質のひとつであることが分かりました。このように、PprAタンパク質の機能解明によって、ラジオデュランスは従来の修復機構とは別の独自の修復機構をもつことが明らかになりました。
二本鎖切断修復の正確性が損傷したDNA末端の構造的な健全性に因っているのであれば、ラジオデュランスにおける二本鎖切断修復は正確性が高いと考えられます。なぜなら、ラジオデュランスは優れた酸化損傷防御機構も兼ね備えているからです。さらに、ラジオデュランスの核様体は他の生物に比べて凝縮の程度が高いので、二本鎖切断修復の反応はより効率的にかつ正確に進むものと考えられます。このような凝縮したゲノムをもつ放射線抵抗性細菌に特有な二本鎖切断修復の機構を、凝縮核様体依存性末端結合(condensed nucleoid-dependent end joining, CNDEJ)と名付けました。CNDEJは、修復の過程で損傷したDNA末端が離れてしまう様な非相同性末端結合(non-homologous end joining, NHEJ)とは異なる機構であると考えています。最近の数々の研究成果の蓄積から、PprAタンパク質はCNDEJで主要な役割を果たしていることが明らかになりつつあります。
高効率DNA修復試薬の実用化
放射線による生物効果で最も重篤な損傷はDNAの二本鎖切断ですが、この二本鎖切断の修復反応は、遺伝子操作技術におけるDNA断片の結合反応と基本的に同じことです。遺伝子操作技術では、DNAクローニングなどの際にDNAリガーゼが汎用されており、DNAリガーゼを用いたクローニングキットが国内外の試薬メーカーから多数販売されています。ラジオデュランスは二本鎖切断に対する修復能力に優れており、その一端をDNA鎖切断部位に結合して修復を促進するPprAタンパク質が担っていることが分かったので、我々はPprAタンパク質のDNA修復促進活性を利用し、DNAリガーゼと組み合わせることで、新しいDNA修復試薬が作れるのではないかと考えました。そこで、市販のDNAリガーゼに、様々な濃度のPprAタンパク質を添加してみたところ、一定の濃度域でDNA連結反応の促進効果が見られたのです。
出願した特許に基づいて技術提供した国内のバイオ試薬メーカーにおける試験でも同様に良好な結果が得られたため、PprAタンパク質は高効率DNA修復試薬として実用化することになり、2005年11月に「TA-Blunt Ligation Kit」(製造:株式会社ニッポンジーン,販売:和光純薬工業株式会社(現:富士フイルム和光純薬工業株式会社))として全国発売されました。この製品は、従来品と比較して、修復反応終了時間が約32倍短縮され、DNA修復効率が約10倍という特徴をもちます。しかも、従来法では結合が難しいとされるタイプのDNA断片の結合に絶大な威力を発揮します。この修復試薬はバイオ研究に幅広く用いられ、遺伝子加工技術や遺伝子診断技術の高度化に役立つものと期待されています。2015年には、 PprAの機能を利用した高効率DNAクローニングキットがバージョンアップして、TA-Enhancer Cloning Kitとして新発売になりました。